28.(14分)
硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是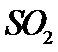 的催化氧化:
的催化氧化: 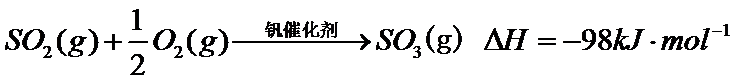 。回答下列问题:
。回答下列问题:
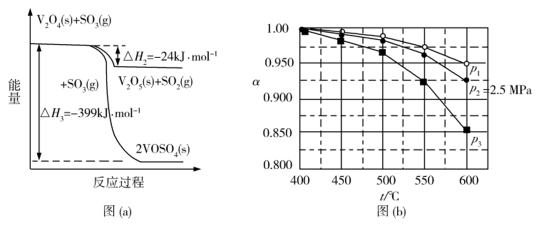
(1) 钒催化剂参与反应的能量变化如图(a)所示,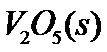 与
与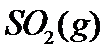 反应生成
反应生成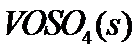 和
和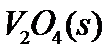 的热化学方程式为:____________。
的热化学方程式为:____________。
(2) 当 、
、 和
和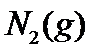 起始的物质的量分数分别为7.5%、10.5%和82%时,在
起始的物质的量分数分别为7.5%、10.5%和82%时,在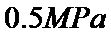 、
、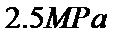 和
和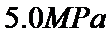 压强下,
压强下, 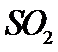 平衡转化率
平衡转化率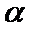 随温度的变化如图(b)所示。反应在
随温度的变化如图(b)所示。反应在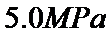 、
、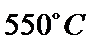 时的
时的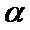 =_________ ,判断的依据是_________。 影响
=_________ ,判断的依据是_________。 影响 的因素有__________。
的因素有__________。
(3)将组成(物质的量分数)为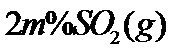 、
、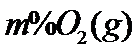 、
、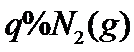 的气体通入反应器,在温度
的气体通入反应器,在温度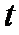 、压强
、压强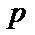 条件下进行反应。平衡时,若
条件下进行反应。平衡时,若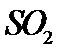 转化率为
转化率为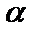 ,则
,则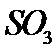 压强为_________ ,平衡常数
压强为_________ ,平衡常数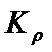 =_____________ (以分压表示,分压=总压×物质的量分数)。
=_____________ (以分压表示,分压=总压×物质的量分数)。
(4)研究表明, 催化氧化的反应速率方程为:
催化氧化的反应速率方程为:
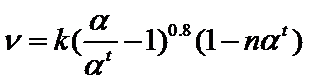
式中: 为反应速率常数,随温度
为反应速率常数,随温度 升高而增大;
升高而增大; 为
为 平衡转化率,
平衡转化率,  为某时刻
为某时刻 转化率,
转化率, 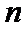 为常数。在
为常数。在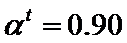 时,将一系列温度下的
时,将一系列温度下的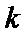 、
、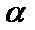 值代入上述速率方程,得到
值代入上述速率方程,得到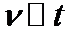 曲线,如图(c)所示。
曲线,如图(c)所示。
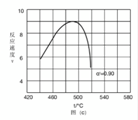
曲线上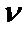 最大值所对应温度称为该
最大值所对应温度称为该 下反应的最适宜温度
下反应的最适宜温度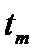 。
。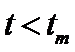 时,
时, 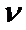 逐渐提高;
逐渐提高; 后,
后,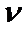 逐渐下降。原因是_____________。
逐渐下降。原因是_____________。
(1). 2V2O5(s)+ 2SO2(g)⇌ 2VOSO4(s)+ V2O4(s) ∆H= -351 kJ∙mol-1 (2). 0.975 (3). 该反应气体分子数减少,增大压强,α提高。所以,该反应在550℃、压强为5.0MPa>2.5MPa=p2的,所以p1=5.0MPa (4). 反应物(N2和O2)的起始浓度(组成)、温度、压强 (5). ![]() (6).
(6). 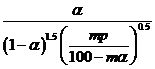 (7). 升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低
(7). 升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低


