2020年天津高考化学答案解析
1.在全国人民众志成城抗击新冠病毒期间,使用的“84消毒液”的主要有效成分是
答案:C
2.晋朝葛洪的《肘后备急方》中记载:“青蒿一握,以水二升渍,绞取汁,尽服之……”,受此启发为人类做出巨大贡献的科学家是
答案:A
3.下列说法错误的是
答案:D
4.下列离子方程式书写正确的
答案:B
5.下列实验仪器或装置的选择正确的是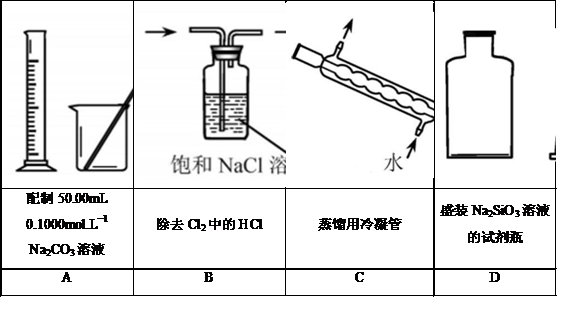
答案:B
6.检验下列物质所选用的试剂正确的是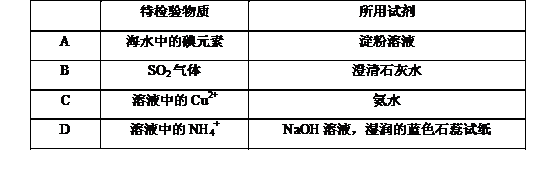
答案:C
8.短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
答案:A
9.关于 的说法正确的是
的说法正确的是
答案:A
10.理论研究表明,在101kPa和298K下,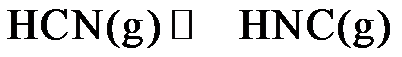 异构化反应过程的能量变化如图所示。下列说法错误的是
异构化反应过程的能量变化如图所示。下列说法错误的是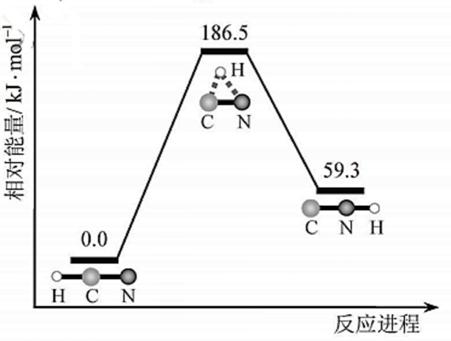
答案:D
11.熔融钠−硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为 (x=5~3,难溶于熔融硫)。下列说法错误的是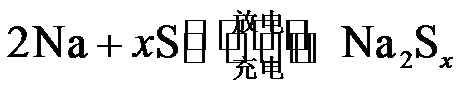
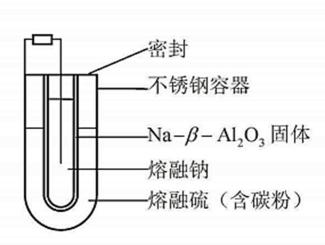
答案:C
12.已知 用该溶液做实验,溶液的颜色变化如下: 以下结论和解释正确的是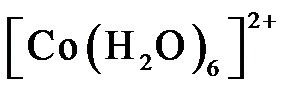 呈粉红色,
呈粉红色, 呈蓝色,
呈蓝色,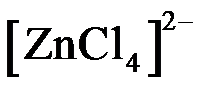 为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:
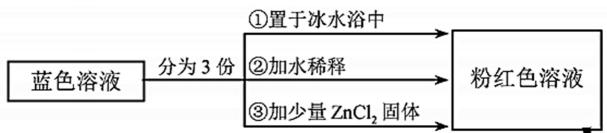
答案:D
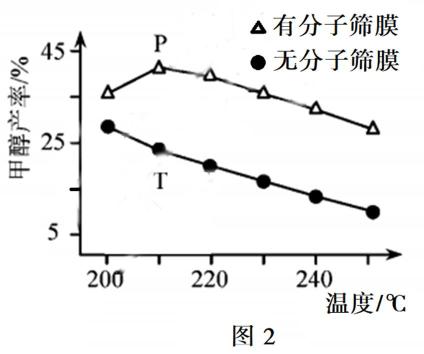
16.(14分)利用太阳能光解水,制备的H2用于还原CO2合成有机物,可实现资源的再利用。回答下列问题: Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物 (1)图1为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为。 (2)若将该催化剂置于Na2SO3溶液中,产物之一为 Ⅱ.用H2还原CO2可以在一定条件下合成CH3OH(不考虑副反应) (3)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为 a mol·L−1和3 a mol·L−1,反应平衡时,CH3OH的产率为b,该温度下反应平衡常数的值为。 (4)恒压下,CO2和H2的起始物质的量比为1∶3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图2所示,其中分子筛膜能选择性分离出H2O。 ①甲醇平衡产率随温度升高而降低的原因为。 ②P点甲醇产率高于T点的原因为。 ③根据图2,在此条件下采用该分子筛膜时的最佳反应温度为°C。 Ⅲ.调节溶液pH可实现工业废气CO2的捕获和释放 (5) ,另一产物为。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式。
,另一产物为。若将该催化剂置于AgNO3溶液中,产物之一为O2,写出生成另一产物的离子反应式。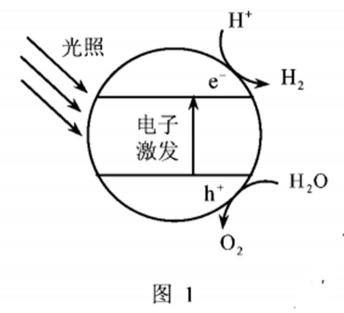
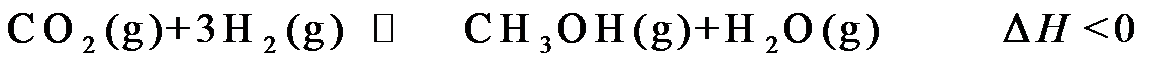
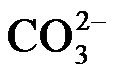 的空间构型为。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,
的空间构型为。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,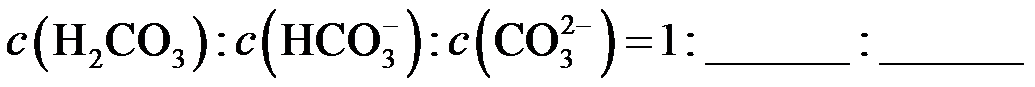 。
。
答案:
(1)光能转化为化学能
(2)H2
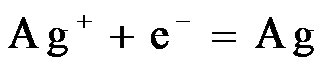 (3)
(3)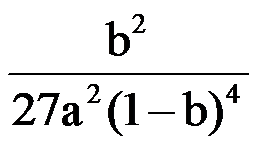 (4)①该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小)
②分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高
③210
(5)平面(正)三角形
(4)①该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小)
②分子筛膜从反应体系中不断分离出H2O,有利于反应正向进行,甲醇产率升高
③210
(5)平面(正)三角形
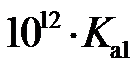
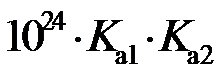



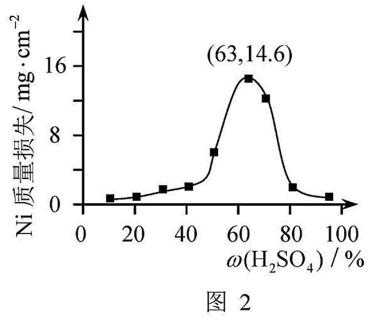
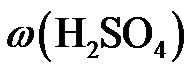 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为。
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为。

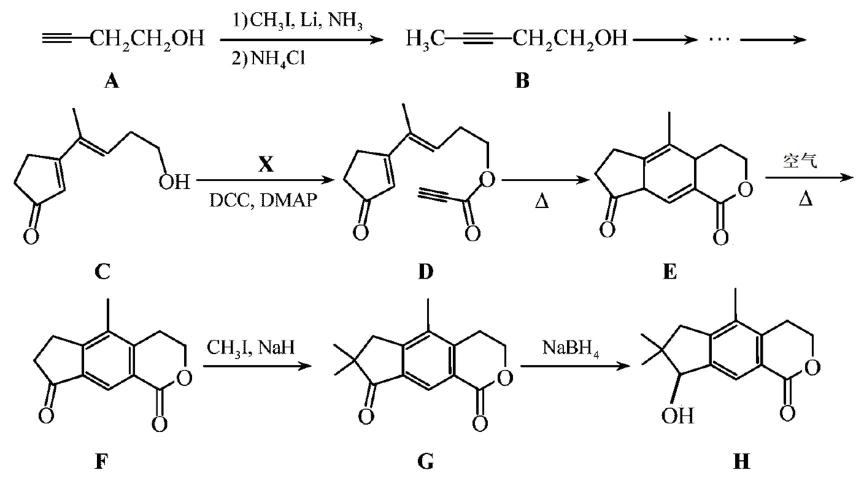
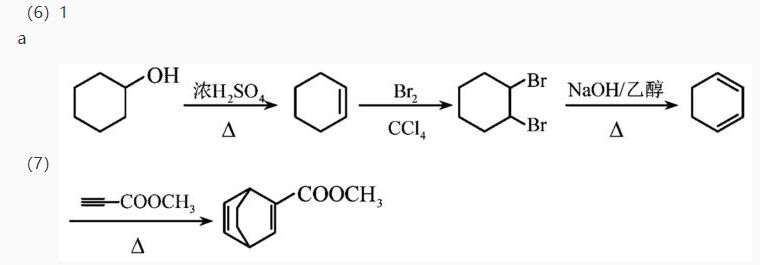
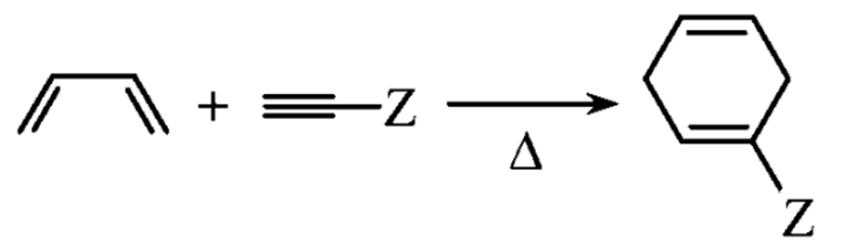 (Z=—COOR,—COOH等)
(Z=—COOR,—COOH等)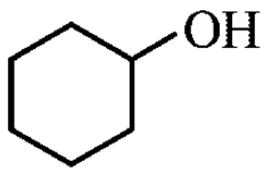 和
和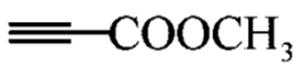 为原料,合成
为原料,合成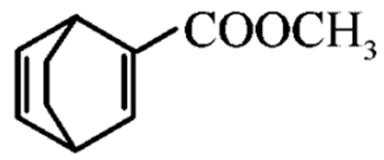 ,在方框中写出路线流程图(无机试剂和不超过2个碳的有机试剂任选)。
,在方框中写出路线流程图(无机试剂和不超过2个碳的有机试剂任选)。
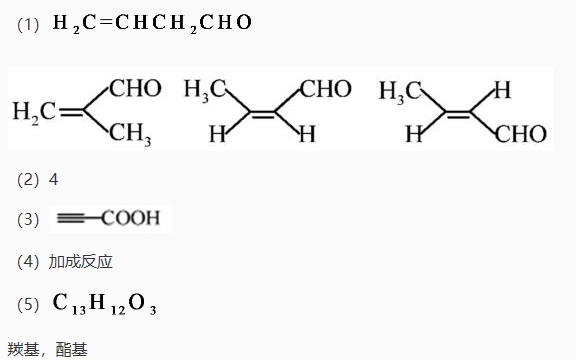
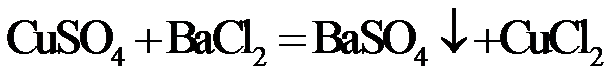
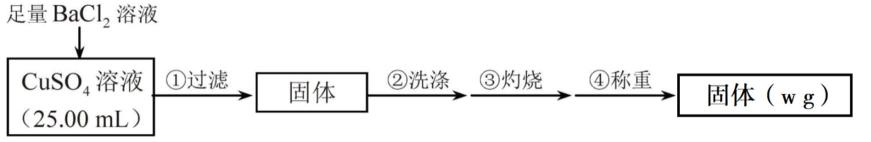
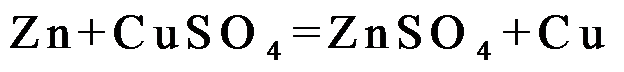
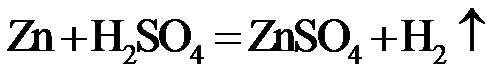
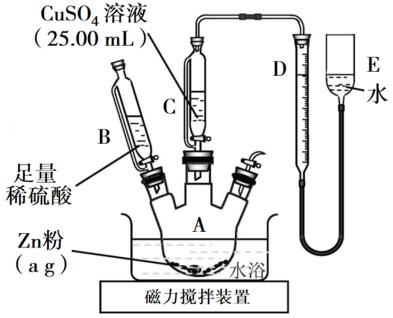
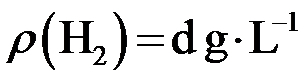 ,则c(CuSO4)_____________mol·L−1(列出计算表达式)。
,则c(CuSO4)_____________mol·L−1(列出计算表达式)。